Badania lekarskie świnek morskich
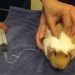
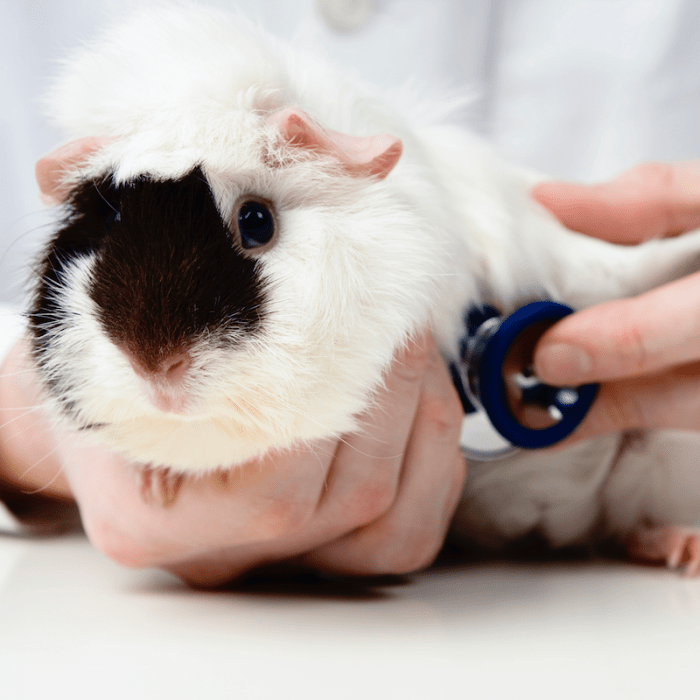
Świnki morskie są wyraźnymi pokojowymi zwierzętami, w stosunku do których nie ma potrzeby stosowania przymusu. Jeśli jednak potrzebują np. pomocy medycznej, boją się, próbując uciec. W takim przypadku zaleca się trzymanie zwierząt. Chociaż czasami wystarczy wziąć wełnę z tyłu głowy, co ogranicza swobodę ruchów.
Świnki morskie są wyraźnymi pokojowymi zwierzętami, w stosunku do których nie ma potrzeby stosowania przymusu. Jeśli jednak potrzebują np. pomocy medycznej, boją się, próbując uciec. W takim przypadku zaleca się trzymanie zwierząt. Chociaż czasami wystarczy wziąć wełnę z tyłu głowy, co ogranicza swobodę ruchów.
Spis treści
Pobieranie krwi od świnek morskich
Przy pewnych umiejętnościach świnki morskie mogą pobierać krew z żyły głowowej. Aby to zrobić, zatrzymaj przepływ krwi przez łokieć za pomocą gumowego bandaża i rozciągnij kończynę zwierzęcia. W razie potrzeby możesz obciąć włosy nożyczkami. Po zdezynfekowaniu wacikiem nasączonym alkoholem, ostrożnie wprowadzić igłę N16. Krew jest pobierana bezpośrednio ze stożka igły. Jeśli do rozmazu potrzebna jest tylko jedna kropla, to po nakłuciu żyły można ją usunąć bezpośrednio ze skóry.
Inną możliwością pobrania krwi jest nakłucie splotu żylnego oczodołu. Po znieczuleniu oka kilkoma kroplami Ophtocain, palcem wskazującym odwróć gałkę oczną na zewnątrz. Następnie ostrożnie wprowadzić mikrotubulę hematokrytową pod gałkę oczną do splotu żylnego oczodołu. Kiedy rurka sięga za splot oczodołowy, naczynia łatwo pękają i wypełniają rurkę włosowatą krwią. Po pobraniu krwi wystarczy lekko uciskać przez 1-2 minuty zamkniętą powiekę, aby zatamować krwawienie. Ta metoda wymaga umiejętności lekarza weterynarii, a także spokojnego stanu pacjenta.
Przy pewnych umiejętnościach świnki morskie mogą pobierać krew z żyły głowowej. Aby to zrobić, zatrzymaj przepływ krwi przez łokieć za pomocą gumowego bandaża i rozciągnij kończynę zwierzęcia. W razie potrzeby możesz obciąć włosy nożyczkami. Po zdezynfekowaniu wacikiem nasączonym alkoholem, ostrożnie wprowadzić igłę N16. Krew jest pobierana bezpośrednio ze stożka igły. Jeśli do rozmazu potrzebna jest tylko jedna kropla, to po nakłuciu żyły można ją usunąć bezpośrednio ze skóry.
Inną możliwością pobrania krwi jest nakłucie splotu żylnego oczodołu. Po znieczuleniu oka kilkoma kroplami Ophtocain, palcem wskazującym odwróć gałkę oczną na zewnątrz. Następnie ostrożnie wprowadzić mikrotubulę hematokrytową pod gałkę oczną do splotu żylnego oczodołu. Kiedy rurka sięga za splot oczodołowy, naczynia łatwo pękają i wypełniają rurkę włosowatą krwią. Po pobraniu krwi wystarczy lekko uciskać przez 1-2 minuty zamkniętą powiekę, aby zatamować krwawienie. Ta metoda wymaga umiejętności lekarza weterynarii, a także spokojnego stanu pacjenta.
Analiza moczu u świnek morskich
Podczas badania pęcherza świnki morskiej jest on delikatnie wyciskany. Jednak zwierzęta oddają mocz, jeśli są umieszczone na ściółce przykrytej pogniecioną plastikową torbą. Z reguły w ciągu godziny pobierana jest wystarczająca ilość do badania.
Nie zaleca się zakładania cewnika u mężczyzn, ponieważ łatwo uszkodzić cewkę moczową. Mocz świnek morskich ma odczyn zasadowy i zawiera kryształy węglanu wapnia i potrójnego fosforanu. Osad można otrzymać w mikrowirówce hematokrytowej.
Podczas badania pęcherza świnki morskiej jest on delikatnie wyciskany. Jednak zwierzęta oddają mocz, jeśli są umieszczone na ściółce przykrytej pogniecioną plastikową torbą. Z reguły w ciągu godziny pobierana jest wystarczająca ilość do badania.
Nie zaleca się zakładania cewnika u mężczyzn, ponieważ łatwo uszkodzić cewkę moczową. Mocz świnek morskich ma odczyn zasadowy i zawiera kryształy węglanu wapnia i potrójnego fosforanu. Osad można otrzymać w mikrowirówce hematokrytowej.
Badanie ściółki u świnek morskich
Dokładne zbadanie ściółki jest konieczne, gdy do kurnika wprowadzana jest nowa świnka morska lub w dużych grupach zwierząt z częstymi wahaniami. W przypadku trzymania pojedynczego zwierzęcia badania są konieczne tylko w rzadkich przypadkach.
Pasożyty wewnętrzne odgrywają niewielką rolę u domowych świnek morskich. W celu stwierdzenia obecności nicieni stosuje się nasycony roztwór chlorku sodu (ciężar właściwy 1,2). W plastikowym kubku o pojemności 100 ml dokładnie wymieszaj 2 g żwirku z niewielką ilością nasyconego roztworu chlorku sodu. Następnie szklankę napełnia się po brzegi roztworem soli kuchennej, zawartość dokładnie miesza się, aby cząstki ściółki były równomiernie rozłożone w roztworze.
Po 5 minutach ostrożnie umieścić szkiełko nakrywkowe na powierzchni roztworu. Osiadają na nim pływające jądra robaków. Po około godzinie szkiełko nakrywkowe można ostrożnie wyjąć z roztworu za pomocą pęsety. Jądra są wyraźnie widoczne pod mikroskopem przy powiększeniu 10-40 razy. Podczas badania parazytologicznego 100 g ściółki miesza się w wodzie wodociągowej z wykorzystaniem technologii sedymentacji w plastikowym kubku o pojemności 5 ml w wodzie wodociągowej tak, aby uzyskać jednorodną zawiesinę, którą przesącza się przez durszlak.
Do przesączu dodaje się kilka kropel płynu do mycia naczyń, pozostawia na godzinę, po czym zlewa wierzchnią warstwę płynu i uzupełnia wodą z detergentem. Po kolejnej godzinie wodę ponownie spuszcza się, a osad dobrze miesza się szklanym prętem. Kilka kropel osadu umieszcza się na szkiełku podstawowym wraz z kroplą 10% roztworu barwnika błękitu metylenowego. Preparat bada się pod mikroskopem przy powiększeniu XNUMXx bez szkiełka nakrywkowego. Błękit metylenowy powoduje, że cząsteczki brudu i rośliny stają się niebiesko-czarne, a jądra żółto-brązowe.
Dokładne zbadanie ściółki jest konieczne, gdy do kurnika wprowadzana jest nowa świnka morska lub w dużych grupach zwierząt z częstymi wahaniami. W przypadku trzymania pojedynczego zwierzęcia badania są konieczne tylko w rzadkich przypadkach.
Pasożyty wewnętrzne odgrywają niewielką rolę u domowych świnek morskich. W celu stwierdzenia obecności nicieni stosuje się nasycony roztwór chlorku sodu (ciężar właściwy 1,2). W plastikowym kubku o pojemności 100 ml dokładnie wymieszaj 2 g żwirku z niewielką ilością nasyconego roztworu chlorku sodu. Następnie szklankę napełnia się po brzegi roztworem soli kuchennej, zawartość dokładnie miesza się, aby cząstki ściółki były równomiernie rozłożone w roztworze.
Po 5 minutach ostrożnie umieścić szkiełko nakrywkowe na powierzchni roztworu. Osiadają na nim pływające jądra robaków. Po około godzinie szkiełko nakrywkowe można ostrożnie wyjąć z roztworu za pomocą pęsety. Jądra są wyraźnie widoczne pod mikroskopem przy powiększeniu 10-40 razy. Podczas badania parazytologicznego 100 g ściółki miesza się w wodzie wodociągowej z wykorzystaniem technologii sedymentacji w plastikowym kubku o pojemności 5 ml w wodzie wodociągowej tak, aby uzyskać jednorodną zawiesinę, którą przesącza się przez durszlak.
Do przesączu dodaje się kilka kropel płynu do mycia naczyń, pozostawia na godzinę, po czym zlewa wierzchnią warstwę płynu i uzupełnia wodą z detergentem. Po kolejnej godzinie wodę ponownie spuszcza się, a osad dobrze miesza się szklanym prętem. Kilka kropel osadu umieszcza się na szkiełku podstawowym wraz z kroplą 10% roztworu barwnika błękitu metylenowego. Preparat bada się pod mikroskopem przy powiększeniu XNUMXx bez szkiełka nakrywkowego. Błękit metylenowy powoduje, że cząsteczki brudu i rośliny stają się niebiesko-czarne, a jądra żółto-brązowe.
Testy skóry i sierści u świnek morskich
Świnki morskie są często atakowane przez roztocza, których obecność jest łatwa do zidentyfikowania. Aby to zrobić, zeskrob niewielką powierzchnię skóry skalpelem, aż pojawi się krew. Powstałe cząstki skóry umieszcza się na szkiełku podstawowym, miesza z 10% roztworem żrącego potasu i bada pod mikroskopem przy dziesięciokrotnym powiększeniu dwie godziny później. Inną możliwością diagnozowania kleszczy jest test czarnego papieru, który jednak jest konieczny tylko w przypadku poważnych zmian.
Pacjent zostaje uśpiony i umieszczony na czarnym papierze. Po pewnym czasie roztocza przemieszczają się ze skóry do sierści, gdzie można je łatwo zobaczyć przez mocne szkło powiększające lub mikroskop. Czasami można je znaleźć na najczarniejszym papierze. Wszy i wszy są widoczne gołym okiem. Jednak praktykom nie zaleca się stosowania tej metody.
Innym częstym problemem są choroby grzybicze. Pobrane próbki skóry i sierści należy przesłać do laboratorium mykologicznego w celu postawienia diagnozy.
Świnki morskie są często atakowane przez roztocza, których obecność jest łatwa do zidentyfikowania. Aby to zrobić, zeskrob niewielką powierzchnię skóry skalpelem, aż pojawi się krew. Powstałe cząstki skóry umieszcza się na szkiełku podstawowym, miesza z 10% roztworem żrącego potasu i bada pod mikroskopem przy dziesięciokrotnym powiększeniu dwie godziny później. Inną możliwością diagnozowania kleszczy jest test czarnego papieru, który jednak jest konieczny tylko w przypadku poważnych zmian.
Pacjent zostaje uśpiony i umieszczony na czarnym papierze. Po pewnym czasie roztocza przemieszczają się ze skóry do sierści, gdzie można je łatwo zobaczyć przez mocne szkło powiększające lub mikroskop. Czasami można je znaleźć na najczarniejszym papierze. Wszy i wszy są widoczne gołym okiem. Jednak praktykom nie zaleca się stosowania tej metody.
Innym częstym problemem są choroby grzybicze. Pobrane próbki skóry i sierści należy przesłać do laboratorium mykologicznego w celu postawienia diagnozy.
Badanie rentgenowskie świnek morskich
Długość i siła ekspozycji do badania rentgenowskiego świnek morskich zależy od użytej kasety oraz rodzaju ekspozycji i rozwoju. Dobre wyniki daje ekspozycja, którą stosuje się w badaniach rentgenowskich małych kotów.
Długość i siła ekspozycji do badania rentgenowskiego świnek morskich zależy od użytej kasety oraz rodzaju ekspozycji i rozwoju. Dobre wyniki daje ekspozycja, którą stosuje się w badaniach rentgenowskich małych kotów.